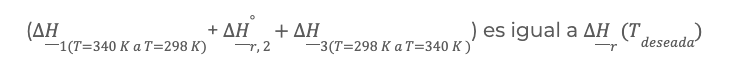Calor de formación, ley de Hess y el efecto
de la condición de temperatura en el calor de reacción
Presentación del tema
Bienvenido a la primera clase del tema termoquímica. En esta sección analizaremos qué sucede cuando se lleva a cabo una reacción química, normalmente cuando estas se llevan a cabo existe un desprendimiento o absorción de energía de los alrededores. Esa cantidad de energía se conoce como calor de reacción. El valor de la cantidad del calor de reacción tiene el siguiente significado físico, imagine que tenemos los reactivos separados a una temperatura dada y 1 atm de presión, por ejemplo 25 °C, al juntarlos en un recipiente (reactor) estos interactúan y existe un intercambio de átomos entre esas moléculas generando nuevos compuestos lo cual se conoce como reacción química. Si tenemos una reacción química donde se lleva a cabo desprendimiento de calor (proceso exotérmico), si se retira el calor generado y se obtienen la temperatura inicial de 25 °C, este calor retirado es precisamente el calor de reacción, y debido a que este se lleva a cabo a 25 °C y 1 atm de presión, este se conoce como el calor de reacción estándar. En otro caso, si al momento de llevar a cabo la reacción química en el sistema hay una disminución de temperatura (proceso endotérmico), entonces es necesario adicionar energía para alcanzar la temperatura inicial. Por lo tanto el calor de reacción es la energía necesaria que se debe adicionar o extraer de un sistema cuando sucede una reacción química, para que la temperatura final sea igual a la temperatura inicial. Cuando los reactivos en la reacción química son elementos o moléculas diatómicas o alótropos más estables, el calor de reacción también se conoce como el calor de formación.
Normalmente es posible encontrar el calor de formación de las moléculas a condiciones estándar en los apéndices de los libros, pero existen casos cuando no es posible encontrar esa información. Existen dos opciones, hacer los experimentos, con lo cual no estaríamos seguros si la reacción química produjo únicamente una molécula sin subproductos, y quizá tampoco sería posible llevar a cabo la reacción química por la falta de equipos y experiencia. Existe una alternativa en la cual podemos hacer el cálculo del calor de formación a partir de los calores de formación y reacción de otras reacciones químicas, que sumados y/o restados nos den la reacción química de formación de la reacción de interés. Lo anterior se fundamenta en que la entalpía es una variable de estado, por lo tanto, no importa la ruta que esta lleve para llegar a estado de interés, en este caso, la reacción química de una molécula a partir de sus elementos o moléculas diatómicas o alótropos más estables.
En esta sección también se analizará el efecto de la condición de temperatura en el calor que se debe agregar o absorber de un sistema que no se encuentra en condiciones estándar. El conocer la dependencia que hay entre la temperatura y el calor de reacción se emplea para operar y controlar el proceso de producción para que se tengas las condiciones más favorables de reacción, ya sea a través de un medio de calentamiento o enfriamiento si se trata de una reacción endotérmica o exotérmica, respectivamente
Objetivo didáctico de la clase
Entender el significado del calor de reacción, calor de formación y su obtención a través de la ley de Hess, además de conocer la importancia del cálculo del calor de reacción en función de la temperatura.
Contenido didáctico
A continuación, se presenta el contenido didáctico de acceso abierto o institucional para profundizar en el tema.
| No. | Nombre del recurso | Sinopsis | Tipo de recurso | Enlace Web |
|---|---|---|---|---|
| 1 | Calor de formación y Ley de Hess. Referencia: Chang R. Fisicoquímica, Tercera edición. | Sección de libro con contenido sobre el tema de calor de reacción. | Archivo | [Acceder] |
| 2 | Calor de formación | Explicación del tema a través de un video. | Video | [Acceder] |
| 3 | Ley de Hess | Video que explica un ejemplo de la Ley de Hess. | Video | [Acceder] |
| 4 | Cálculo del calor de reacción a partir de los calores de formación | Ejercicio para el cálculo del calor de reacción a partir del calor de formación. Nota: siempre usen unidades cuando hagan los cálculos | Video | [Acceder] |
| 5 | Dependencia entre entalpía de reacción y temperatura | Texto sobre la deducción de la expresión para el cálculo de la entalpía de reacción en función de T | Archivo | [Acceder] |
| 6 | Calor de reacción a cualquier temperatura | Deducción más detallada de la ecuación para el cálculo de la entalpía de reacción a cualquier temperatura | Video | [Acceder] |
| 7 | Problema sobre el cálculo del calor de reacción | Solución de problemas para el cálculo del calor de reacción en función de la temperatura | Video | [Acceder] |
Material didáctico complementario
| No. | Nombre del recurso | Sinopsis | Tipo de recurso | Enlace Web |
|---|---|---|---|---|
| 1 | Calor de formación, calor de reacción. Fuente: Levine, I.N. Fisicoquímica Vol. 1. Quinta edición. | Este material contiene información sobre los calores de formación y entalpía de reacción | Archivo | [Acceder] |
| 2 | Ley de Hess | Video que explica un ejemplo de la Ley de Hess | Video | [Acceder] |
| 3 | Dependencia de los calores de reacción con la temperatura | Material complementario del tema: Levine, I.N. (2004) Fisicoquímica Vol. 1. | Archivo | [Acceder] |
| 4 | Dependencia del calor de reacción con la temperatura | Material complementario del tema: Castellan, G.W. (1987) Fisicoquímica 2da. edición | Archivo | [Acceder] |
Resumen e ideas relevantes de la clase digital
La importancia de calcular y conocer el calor de reacción en un sistema reactivo es de gran importancia, ya que ese dato proporciona qué cantidad de energía se debe adicionar o extraer de un sistema para alcanzar una determinada condición de temperatura.
En esta sección también se analizó la relación y dependencia que hay entre la temperatura y el calor de reacción, donde es necesario manipular la cantidad de energía que se debe agregar o retirar de un sistema (calor de reacción) para alcanzar la temperatura deseada. Las condiciones deseadas se pueden obtener a través de la correcta operación y control del proceso. Las reacciones químicas normalmente no se dan a condiciones normales y por ello es necesario el realizar cálculos basados en el principio de los estados termodinámicos, es decir, no importan la ruta que sigan los cálculos, ya que la sumatoria de todos los pasos intermedios, serán igual a la diferencia entre el estado final y el estado inicial, y precisamente la ley de Kirchhoff se basa en este principio, por ejemplo, deseamos saber cual es el calor de reacción a una temperatura
Tdeseada = 340 K
En este caso se realizan 3 cálculos de intercambio de energía entre en el sistema y sus alrededores, el primer paso
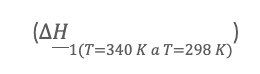
es calcular la cantidad de energía que los reactivos debe perder para que pase de una T2 a una temperatura estándar de 298 K, el segundo paso cálculo es el calor de reacción
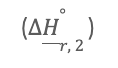
a una temperatura estándar empleando tablas de calores de formación, la ley de Hess o las energías de enlace, y por último calcula el calor
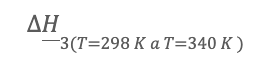
que se debe agregar para que los productos pasen de una temperatura estándar (298 K) a una temperatura de reacción
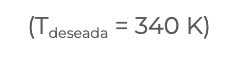
la suma de los 3 intercambios de calor